高中化学实验:制备硝酸铜
引言:
化学实验是高中化学教学中重要的一环,通过实际操作可以帮助学生更深入地理解化学原理和学术知识。本文将介绍制备硝酸铜的实验过程,通过该实验学生可以了解化学反应的原理,并掌握实验操作技巧。

一、实验原理
硝酸铜是由铜和硝酸反应制得的无机化合物。该反应的化学方程式为:
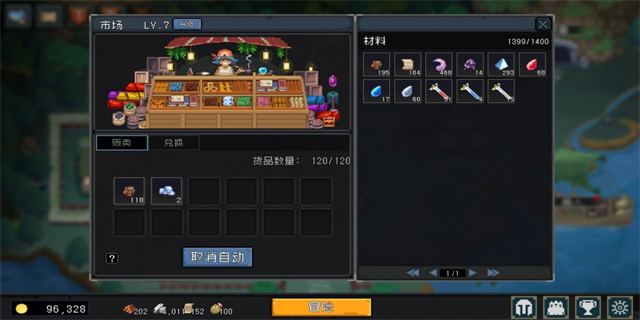
铜 + 硝酸 → 硝酸铜 + 氮氧化物
硝酸铜具有深蓝色的结晶体,是一种常用的实验试剂。它广泛应用于颜料、催化剂等方面。本实验的目的是通过反应制备硝酸铜,并通过实验步骤和观察结果,探究反应过程中发生的化学变化。
二、实验材料
- 铜粉
- 稀硝酸
- 蒸馏水
- 烧杯
- 集气瓶
- 滤纸
- 灯
- 高温热板
- 密封瓶
三、实验步骤
1. 准备工作:
将铜粉称取5g,并放入烧杯中。
2. 反应:
向烧杯中加入20mL的稀硝酸,并加热。反应发生时,会有气泡产生。
3. 加热:
将烧杯放置在高温热板上,加热至稀硝酸完全蒸发。期间要注意火焰的大小和温度的控制,确保不会发生溅溢。
4. 冷却:
冷却烧杯,待其达到室温后,可观察到蓝色的晶体沉积在烧杯底部。
5. 过滤:
将烧杯底部的蓝色晶体倒入滤纸上,过滤掉杂质。
6. 获取产品:
将纯净的硝酸铜晶体转移到密封瓶中保存。
四、实验注意事项
1. 安全:
实验中注意安全,避免溅溢和烧伤,严禁过量的铜粉进入实验瓶。
2. 温度:
加热时要控制火焰大小和温度,避免溅溢。
3. 过滤:
过滤时要注意滤纸的质量和过滤速度,确保产品的纯度。
4. 储存:
保存硝酸铜时应放置在干燥的容器中,避免潮湿。
五、实验结果与分析
通过该实验得到的硝酸铜晶体呈现出深蓝色,可通过比色法测定溶液浓度。该实验还可以根据产生的气体以及反应的颜色变化等现象来观察化学反应的特点,并进一步深化对化学反应原理的理解。
结论:
通过本实验,我们成功地制备了硝酸铜,并学习了铜与硝酸之间的化学反应。这个实验不仅锻炼了我们的实验操作能力,同时也让我们更加深入地了解了化学反应的原理和现象。
参考文献:
无